Capítulo 5, "O Poder Curativo da Química"

Russell Barrow
De onde veio aquele medicamento? Os cientistas estão a procurar novos medicamentos em locais pouco convencionais — alguns, mesmo verdadeiramente, desagradáveis. Por exemplo, o químico Jim Gloer da University of Iowa, Iowa, que está a pesquisar novos antibióticos produzidos por um tipo de fungo que se desenvolve em excrementos de animais. Sim, leste bem: fezes de animais. Estes organismos que ninguém inveja designados por coprófilos — literalmente, que gostam de fezes — são um tipo de microrganismos pouco estudado, mas muito promissor para a descoberta de novos medicamentos. Por muito estranho que pareça, estes fungos são terrivelmente territoriais, libertando substâncias químicas tóxicas para as espécies de fungos que os rodeiam (e que, por isso, competem com eles). Isto é precisamente aquilo que os investigadores biomédicos procuram — substâncias químicas que envenenem certos tipos de fungos nocivos e que podem ser perigosos para as pessoas com eles infetadas.
Aquele objetivo é importante. Devido em parte à doença e em parte ao tratamento, doenças como a SIDA e cancro tornam muitas vezes o organismo mais suscetível à ação de microrganismos que, em circunstâncias normais, não causariam quaisquer problemas. Estas infeções oportunistas são frequentemente provocadas por apenas alguns tipos de fungos. Infelizmente, não existem atualmente muitos medicamentos disponíveis, que permitam eliminar estas ameaças microbianas sem provocar graves efeitos secundários. Uma vantagem fundamental na estratégia de Gloer consiste no facto de a sua abordagem para encontrar compostos antifúngicos não ser aleatória (como acontece tipicamente em muitos processos de deteção de drogas antimicrobianas). Ao selecionar compostos que ele sabe à partida serem capazes de erradicar outros fungos, Gloer está a partir de um conjunto de moléculas em que todas possuem exatamente o tipo de atividade capaz de eliminar células, que ele procura.
Explorando o Mar

Os vastos e inexplorados mares são outra promissora fonte de medicamentos. Os cientistas estão a explorar as profundezas dos oceanos na tentativa de descobrir novas moléculas em organismos como esponjas, moluscos e uma grande diversidade de outras criaturas marinhas. Pode parecer surpreendente que, na generalidade, nadadores velozes e predadores bem sucedidos não sejam aquilo que os investigadores procuram. Pelo contrário, os cientistas aprenderam a apreciar a extraordinária riqueza química que está à espera no interior dos "mandriões" mais saborosos e mais vivamente coloridos dos mares — os denominados filtradores que se fixam às rochas e a corais. Precisamente porque não podem deslocar-se — ou porque sobressaem devido à sua coloração externa — estes animais são sofisticados laboratórios de química. Para se protegerem e competirem por alimento e outros recursos, estes animais envolvem-se em batalhas químicas dia sim, dia não. Os cientistas descobriram que alguns destes potentes químicos são extremamente promissores para o tratamento de cancro e de outras doenças. Certos compostos passaram numa inspeção inicial — mostrando-se promissores em estudos em tubos e ensaio e em animais — e progrediram agora até à fase de testes clínicos em humanos. Mas, embora haja potenciais medicamentos muito promissores à espera nos oceanos, um obstáculo que se coloca consiste em extraí-los em quantidades suficientes. Os investigadores estão a descobrir um modo de ultrapassar este dilema, através do desenvolvimento de métodos que permitam produzir estes compostos nos seus laboratórios. Mas há grandes obstáculos à síntese eficiente de quantidades utilizáveis de muitos destas substâncias químicas. Em aquacultura ("cultivo" aquático) os investigadores criam em tanques pequenos e especializados, grandes quantidades de organismos que produzem compostos que existem em ínfimas quantidades na Natureza.
Acontece que os organismos marinhos albergam potenciais medicamentos. Explorando esta potencialidade os cientistas estão a descobrir que organismos unicelulares fotossintéticos, denominados microalgas, que "andam à boleia" em organismos marinhos maiores, são também bons produtores de substâncias químicas interessantes. As plantas terrestres têm sido uma fonte de substâncias químicas desde há milhares de anos, pelo que não é de admirar que os compostos produzidos pelas microalgas, comecem a ser encarados como potenciais medicamentos para combater cancro, doenças cardíacas e muitos tipos de infeções. Organismos miniaturais "parecidos" com plantas, designados por cianobactérias, que vivem numa variedade de ambientes aquáticos — água doce ou salgada, ou mesmo solos húmidos — estão a mostrar-se também como excelentes fontes de poderosos agentes no combate a cancro e a células bacterianas. Dick Moore da University of Hawaii at Manoa utilizou com sucesso uma estratégia para encontrar compostos especificamente eficientes contra tumores sólidos de crescimento lento e difíceis de tratar (aqueles que se acumulam como nódulos de células tumorais em vários órgãos e são responsáveis pela maioria das mortes provocadas por cancro). Um destes compostos por ele encontrado, designado por criptoficina-8, é capaz de destruir a estrutura celular num amplo espectro de tumores sólidos implantados em ratinhos, incluindo aqueles com resistência múltipla a medicamentos, que já não são suscetíveis aos medicamentos anticancerígenos tradicionais. Moore descobriu outra molécula derivada de cianobactérias, denominada majusculamida C, que atua de modo idêntico, mas em células de fungos, o que a torna potencialmente útil para o tratamento de doenças provocadas por fungos em humanos, bem como em culturas agrícolas.
Tradicionalmente, os cientistas primeiro encontram na terra ou no mar substâncias químicas naturais interessantes que se mostram promissores no combate a doenças, e depois aprendem a sintetizá-los artificialmente. Em última instância, muitos dos melhores medicamentos têm sido desenvolvidos como resultado da manipulação de compostos naturais pelos bioquímicos com o objetivo de manter porções terapêuticas de moléculas úteis, enquanto eliminam componentes que podem provocar efeitos secundários indesejáveis.
Um Papel Principesco

Todos sabemos que os sapos não se transformam em príncipes, mas os cientistas suspeitam que a pele dos sapos se pode transformar em úteis medicamentos. No final da década de 80, enquanto trabalhava num laboratório dos National Institutes of Health, Bethesda, Maryland, o biólogo Michael Zasloff questionou-se porque é que os sapos com feridas cirúrgicas normalmente se curavam perfeitamente sem desenvolver infeções, apesar de viverem num aquário de laboratório relativamente sujo. Zasloff dirigiu a sua atenção para esta curiosa observação e conseguiu isolar um péptido — uma cadeia de aminoácidos — chamada magainina (denominada a partir da palavra hebraica que significa escudo), que os sapos produzem como resposta a lesões na pele.
Zasloff rapidamente verificou que ninguém tinha uma ideia de como é que a lula gigante ou o polvo — que não têm nem anticorpos, nem glóbulos brancos, denominados linfócitos — evitam ficar totalmente contaminados por microrganismos! Ao longo dos anos, ele e os seus colegas identificaram muitos péptidos produzidos por sapos que possuem poderosas propriedades antimicrobianas. Um sistema de defesa químico deste tipo funciona através da capacidade que os péptidos têm de perfurar as membranas celulares que protegem as bactérias do ambiente externo. Para além dos péptidos, os cientistas, incluindo Zasloff, encontraram centenas de outros tipos de moléculas denominados alcaloides, na pele de anfíbios. Uma vez no interior das células, muitos alcaloides alojam-se em estruturas designadas por canais iónicos — estruturas em forma de túnel por onde passam importantes eletrólitos. Estes são estruturas celulares fundamentais, uma vez que controlam a entrada e saída de moléculas carregadas eletricamente através das membranas celulares. Como tal, são também importantes alvos de medicamentos. Alguns canais, por exemplo, dão início a uma cascata de eventos moleculares que "dizem" à célula para "sentir" dor. Os investigadores descobriram que uma molécula específica isolada da pele de sapo, designada por epibatidina, tem uma poderosa atividade analgésica devido à capacidade de o composto se ligar a canais deste tipo. Após a terem estudado, os cientistas aperceberam-se que a epibatidina era demasiado tóxica para ser utilizada como analgésico. Os investigadores aprenderam a produzir a molécula em laboratório e têm continuado a manipular a sua estrutura química com o objetivo de fabricar uma substância que possa aliviar a dor sem produzir efeitos secundários indesejáveis.
Curiosamente, os cientistas pensam que muitas das "drogas" alcaloides na pele dos sapos são provenientes de insetos, de aranhas e de outros artrópodes em particular de que eles se alimentam.
Fazer Medicamentos
Uma função essencial desempenhada pelos bioquímicos é aprender a simular eficazmente os abundantes processos de fabrico da natureza. Ocasionalmente, uma estratégia deste género — quando corre bem — pode contar uma história de sucesso. Robert Holton, um especialista em química orgânica da Florida State University, Tallahasee, descobriu uma forma de produzir quantidades comercialmente úteis de Taxol®, uma droga anticancerígena líder de vendas mundial. Esta substância, que os médicos usam (frequentemente em combinação com outros anticancerígenos) para tratar cancro do ovário e da mama, foi descoberta pela primeira vez na década de 60. Os cientistas encontraram o Taxol® na casca do teixo do Pacífico, que cresce no noroeste dos Estados Unidos. Mas havia um problema. O teixo do Pacífico é uma espécie ameaçada, de crescimento lento. Holton ajudou a construir o percurso até ao sucesso atual do Taxol® com uma abordagem prática: desenvolveu uma maneira de produzir o medicamento a partir de um ingrediente mais acessível que é abundante no mais numeroso teixo Europeu. Holton licenciou a sua tecnologia semissintética à empresa farmacêutica Bristol-Meyers Squibb e, desde 1992, quando a FDA aprovou a forma sintética de Taxol®, Holton ganhou milhões de dólares em direitos de autor. Alguns anos mais tarde, foi liderar o primeiro grupo de cientistas a produzir Taxol® totalmente a partir do nada. Em vez de descansar sobre os seus louros, Holton investiu grande parte das suas recompensas novamente na investigação, fundando a MDS Research Foundation em 1995. Por sua vez, esta organização sem fins lucrativos licenciou a tecnologia de Holton na Florida State University e criou uma empresa denominada Taxolog dedicada à produção de moléculas análogas ao Taxol® (designadas por taxanos) que são mais eficazes no tratamento de cancro. Através deste acordo, os lucros resultantes de novos agentes antitumorais são aplicados novamente na investigação básica em química sintética.
Atua Como uma Proteína, Mas Não o É
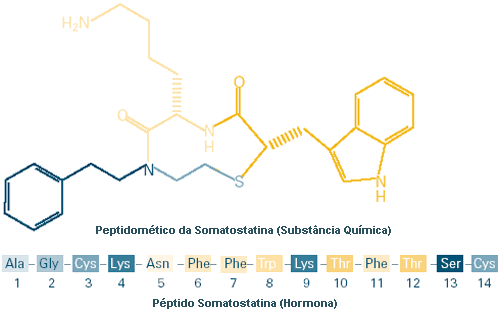
Conceber medicamentos é um negócio complicado. Muitos potenciais medicamentos parecem bem no papel, mas um medicamento apenas pode desempenhar a sua função de tratamento de um sintoma ou de combate a uma doença, se conseguir chegar até ao local do organismo adequado ao desempenho dessa função. Isso é difícil, uma vez que muitos medicamentos modernos são versões sósias das moléculas naturais do organismo — pequenas partes de proteínas designadas por péptidos que se devem ligar a outras proteínas alvo, como os recetores. O problema é que o sistema digestivo degrada as proteínas, e os péptidos, como uma parte normal do metabolismo (obtenção de energia a partir de alimento). Por isso o que deve um designer de medicamentos fazer? Muitos optaram por procurar moléculas denominadas peptidomiméticos, que possuem muitas das úteis propriedades dos péptidos (no sentido em que simulam importantes alvos biológicos), mas que diferem destes de outras formas significativas. Os bioquímicos envolvidos no desenvolvimento de medicamentos tentam fazer cópias que são absorvidas pelo organismo, resistem a enzimas digestivas, e permanecem tempo suficiente na corrente sanguínea para chegar aos tecidos e aos órgãos onde são necessários. Medicamentos como estes estão já a ser utilizados na prática clínica para tratar infeções, doenças cardíacas e cancro. Contudo, um fator fundamental para tornar estes sósias úteis consiste em levar o organismo a "pensar" que são moléculas naturais e não medicamentos. Isso é importante, uma vez que, para chegar aos locais onde devem atuar, os peptidomíméticos recorrem frequentemente aos sistemas de transporte molecular naturais do organismo.
Bioquímica em Ação: A Pesquisa em Bibliotecas Compensa
Os cientistas Gary Glick e Jonathan Ellman nunca tencionaram trabalhar no mesmo problema, mas agora trabalham. E a colaboração está a ser bem produtiva. Duas mentes elucidadas podem ser melhor do que uma — a parceria destes dois cientistas resultou em, pelo menos, um novo medicamento promissor para o tratamento de uma doença autoimune devastadora denominada lúpus eritematoso sistémico, frequentemente designada apenas por lúpus. De acordo com a Lupus Foundation of America, esta doença afeta 1,5 milhões de americanos, alguns dos quais exibem um eritema característico ao nível da região nasal designado por "eritema em asas de borboleta", devido à sua forma. A lúpus afeta o sistema imunitário, ao levar os rins a atacar o seu próprio DNA. Os tratamentos existentes são ineficazes e têm efeitos secundários graves e limitativos. Glick, da University of Michigan-Ann Arbor e Ellman, da University of California, Berkeley, tentam identificar um medicamento para o tratar a lúpus, recorrendo ao poder da química combinatória para rapidamente analisar milhares de moléculas. A equipa começou com um grande catálogo de estruturas moleculares e procurou compostos que pudessem eliminar as células responsáveis pelo lúpus (linfócitos autoimunes), preservando as células imunitárias normais. Este esforço de descoberta de um medicamento só é possível com o advento da química combinatória, uma vez que, antes de os cientistas selecionarem as moléculas com as propriedades desejadas, têm que ser testados números muito elevados de compostos (bibliotecas). A pesquisa de Glick e de Ellman levou-os até uma interessante molécula candidata que inibe o lúpus em ratinhos propensos ao desenvolvimento da doença. Uma característica particularmente interessante da recém-descoberta molécula é que, depois de administrada aos ratinhos propensos ao desenvolvimento da doença, estes não sofrem quaisquer dos severos efeitos secundários comuns a todos os medicamentos antilúpus atualmente comercializados. Glick e Ellman estão a preparar-se para testar o composto em humanos.
À Esquerda ou à Direita?
Fazer substâncias químicas no laboratório não é exatamente o mesmo do que cozinhar um tacho de esparguete, em que simplesmente se coze a massa, se aquece o molho e voilà! Não é assim tão fácil fazer moléculas a partir de uma receita de laboratório. O que se passa é que, muitas moléculas pequenas — criadas por cientistas ou pela natureza — existem sob duas formas simétricas, uma "esquerda" e uma "direita". As moléculas que constituem o DNA obedecem a este princípio, designado por quiralidade, que, na realidade, tem origem nas leis da física. As ligações químicas — as forças físicas que atraem ou repelem os átomos nas moléculas — rodam no espaço de duas maneiras, dando origem a duas formas moleculares complementares, como imagens refletidas num espelho. Estas formas são como uma mão esquerda e uma mão direita — quando se juntam, elas combinam, mas nunca se alinham quando posicionadas uma sobre a outra. Por outras palavras, uma mão direita nunca vai encaixar numa luva de mão esquerda.
Para que é que tudo isto interessa no que respeita a drogas? Bem — tomemos, por exemplo, o caso de um medicamento constituído por uma pequena molécula que desempenha a sua função no organismo ao ligar-se especificamente a uma cavidade particular de um determinado recetor proteico. A versão relativa à mão esquerda deste medicamento pode encaixar perfeitamente no local correto no interior do recetor, enquanto a correspondente mão direita, inevitavelmente, não consegue caber. E em algumas situações, ambas as versões de um medicamento (cada uma das quais se designa por enantiómero) encaixam num local biológico, mas uma pode auxiliar a tratar um sintoma, enquanto outra pode ser nociva para o organismo!
Uma terrível tragédia ocorreu quando isto aconteceu com uma substância química denominado talidomida, que foi utilizado na década de 60 para tratar o enjoo matinal em mulheres grávidas. Os cientistas descobriram tarde demais que uma das duas mãos da talidomida provocava horríveis malformações congénitas. Para além disso, os investigadores descobriram que a eliminação da mão "má" de uma dose de talidomida não resolvia o problema — o organismo é capaz de produzir por si mesmo a mão nociva a partir da "boa".
Outra droga que também tem duas caras, neste sentido, é o popular medicamento para alergias denominado Seldane®, que foi removido do mercado pela Food and Drug Administration em 1997, porque, quando em combinação com um certo antibiótico, causava problemas potencialmente letais a nível do ritmo cardíaco. Os cientistas determinaram que nenhum dos enantiómeros de um produto da degradação do Seldane® — atualmente comercializado como um medicamento denominado Allegra® — interage do mesmo modo com o antibiótico, sendo o Allegra® utilizado com segurança por milhões de americanos.
Para fabricar produtos rápida e eficientemente do ponto de vista económico, as companhias farmacêuticas tradicionais têm "cozinhado" quimicamente medicamentos que contêm porções idênticas de "mãos" esquerda e direita. Isto porque, geralmente, é muito menos eficaz e mais dispendioso produzir apenas uma versão da substância. Contudo, com o passar do tempo, os químicos na indústria e noutros locais aperceberam-se da importância de produzir compostos só com uma versão. Há aquelas situações particularmente problemáticas em que um dos enantiómeros é tóxico. Mas na grande maioria dos casos, muitos dos medicamentos produzidos como misturas de "mãos" esquerda e direita têm apenas metade da potência que poderiam ter, uma vez que uma das versões não faz mais do que diluir o medicamento produzido. O químico Eric Jacobsen da Harvard University, passou anos a aperfeiçoar uma ferramenta laboratorial — um catalisador quiral — que é capaz de produzir um e apenas um enantiómero de um tipo de molécula particular. Isto elimina o desperdício inerente ao processo de produção de uma mistura de "mãos" esquerda e direita, ou à separação dos enantiómeros após o fabrico. A empresa farmacêutica Merck reconheceu o valor da ferramenta de Jacobsen e tem-na utilizado com sucesso na produção de um medicamento amplamente utilizado contra a SIDA denominado Crixivan®. Outros cientistas, como K. Barry Sharpless do Scripps Research Institute, têm feito reações químicas à medida, que produzem apenas um enantiómero. O método assemelha-se à eliminação do acaso num jogo de moeda ao ar, para que esta caia sempre de modo a dar caras. As reações de Sharpless, que dão origem a intermediários químicos de uma só "mão", foram importantes para a produção de diversas substâncias químicas com utilidade na medicina, incluindo alguns antibióticos, medicamentos cardíacos e antidepressivos. Sharpless foi premiado com o Prémio Nobel da Química em 2001, pela sua descoberta de catalisadores quirais.
Hoje em dia os bioquímicos, investindo esforços na pesquisa da forma certa (a direita ou a esquerda, conforme o caso), têm grandes oportunidades para aperfeiçoar os medicamentos existentes — eliminando efeitos secundários relacionados com a dose, por exemplo — ou simplificando o processo de produção de novos medicamentos mais eficientes.
No Meio
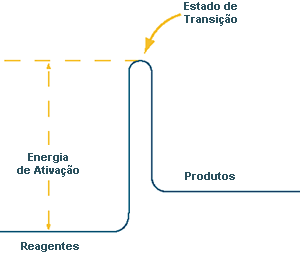
Quando se pensa em reações químicas, somos tentados a focar apenas duas coisas: o que entra (as matérias primas, os reagentes) e o que sai (o produto ou produtos). Por vezes, não se dá atenção a todos os aspetos excitantes que ocorrem pelo meio. Pensa numa reação química como sendo dois vales com uma montanha no meio. Para se converterem em produtos (um vale), os reagentes (o outro vale), têm que ultrapassar algo que os químicos designam por energia de ativação, ou "pico de energia". Nesta analogia da montanha, o pico de energia é o ponto mais alto entre dois vales. A nível molecular, este ponto, no espaço e no tempo, é designado por estado de transição, e representa um instante de ligações quebradas ou estabelecidas, que apenas dura um bilionésimo de segundo. De certo modo, o estado de transição é o ponto exato no qual o balancé se inclina para o outro lado. Apesar da sua existência fugaz, os estados de transição são muito procurados pelos químicos que, intencionalmente procuram alterar reações para um lado ou para outro conhecendo os pormenores deste micro momento crucial.
Um Trabalho Sem Saída
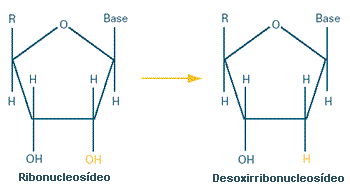
Durante muitos anos, a química JoAnne Stubbe do Massachusetts Institute of Technology tem vindo a identificar cada passo de uma via bioquímica essencial à síntese das unidades estruturais de DNA. Concentrou as suas energias particularmente numa importante enzima desta via, denominada ribonucleotídeo redutase, ou RNR. No decurso dos seus estudos, Stubbe descobriu o modo como a RNR se liga ao seu substrato — o que a dotou de um conhecimento estratégico que usou para desenvolver moléculas sósias que se adaptam à forma da enzima, mas não a fazem funcionar. Compostos como estes, designados por substratos suicida, bloqueiam completamente a enzima alvo. Eles iludem a enzima, levando-a a "pensar" que está a desempenhar a sua função, mas na realidade, nenhuma função é desempenhada. As células cancerígenas — que se dividem tão rápido como podem — são super-produtoras de DNA, e podem ser lesadas por qualquer medicamento que interfira com este processo. Stubbe e os seus colegas da indústria, conduziram estudos sobre um destes substratos suicida de RNR em tubo de ensaio e em animais até testes em pessoas. Os testes clínicos com este potencial medicamento contra o cancro estão a caminho.
Perdendo Medicamentos
Descobrir ou produzir novos medicamentos que sejam eficazes é em si mesmo um desafio. Mas, para complicar ainda mais, por vezes medicamentos perfeitamente bons deixam simplesmente de funcionar. Muito frequentemente são medicamentos utilizados para tratar infeções bacterianas ou fúngicas. É verdade que no século passado se fizeram importantes avanços no que diz respeito ao tratamento de doenças infecciosas provocadas por bactérias, vírus e outros microrganismos, como parasitas. O aumento da longevidade humana durante o século passado deve-se, largamente, ao tratamento das infeções: hoje em dia sucumbe-se à infeção com muito menos frequência do que há 50 ou 100 anos. Mas este sucesso acarreta um preço — muitos antibióticos que outrora eliminavam as bactérias facilmente, atuam hoje com muito menos eficácia, se chegarem a atuar. No instante de tempo evolutivo em que estes avanços ocorreram e foram aplicados rotineiramente à prática médica, os microrganismos recuperaram. Estão a ficar "espertos" e a desenvolver modos de escapar à ação de venenos (os nossos medicamentos). Os organismos resistentes a medicamentos representam uma séria ameaça à saúde.
Felizmente, muitos bioquímicos e biólogos estão à altura da situação e a trabalhar arduamente para vencer os microrganismos que desenvolvem resistência. Atualmente estão a ser desenvolvidas novas formas de antibióticos: a maioria está a ser especificamente personalizada de modo a minimizar a hipótese de as bactérias se lhes tornarem resistentes.
Bioquímica em Ação: A Forma do Que Está Para Vir

Uma das maravilhas da ciência é a partilha de informação. Por vezes, uma colisão de descobertas em áreas científicas completamente diferentes traz importantes avanços. Ao associar os avanços das áreas da química quiral e da biologia estrutural (na qual os cientistas determinam a configuração tridimensional de moléculas biológicas), Arun Ghosh da University of Illinois, Chicago desvendou alguns potenciais medicamentos promissores no combate à SIDA. Ghosh e os seus colegas debruçaram-se sobre os resultados de outros cientistas que estudam a estrutura tridimensional de uma enzima, designada por HIV protease, que é fulcral para a sobrevivência deste vírus mortífero. Utilizando o método de K. Barry Sharpless para uniformizar o resultado de reações químicas de modo a produzir moléculas com uma só configuração, Ghosh concebeu arduamente compostos robustos que se ligam firmemente a uma secção importante desta proteína vírica essencial. Ao fazê-lo, Ghosh obteve uma bateria de potenciais medicamentos que, em alguns casos, são 50 vezes mais potentes do que as substâncias inibidoras da protease amplamente utilizadas como uma forma básica de terapia da SIDA em humanos. Ghosh desenvolveu novos compostos, que estão a ser submetidos a testes em animais, de forma a ultrapassar dois pontos fracos inerentes aos inibidores da protease HIV atualmente no mercado. Uma vez que as enzimas digestivas do organismo desfazem facilmente as ligações químicas que estruturam as proteínas (as denominadas ligações peptídicas), Ghosh concentrou-se em moléculas que se assemelham a mini proteínas, mas que não são reconhecidas como tal pelas enzimas que degradam proteínas. Dado que os cientistas suspeitam que a resistência a medicamentos é frequentemente desencadeada por uma ausência crítica de ligações químicas entre a protease viral e o medicamento, Ghosh está a atacar o problema da resistência através do desenvolvimento de compostos que se associam à protease do vírus do HIV em várias regiões diferentes.
Aperfeiçoando Medicamentos
O ácido acetilsalicílico — normalmente designado por aspirina — é um medicamento muito antigo. Também é muito eficaz, estando disponível sem receita médica para uma grande diversidade de utilizações. A aspirina é um medicamento pouco dispendioso utilizado para tratar dor e edema de pequenas lesões cutâneas ou queimaduras solares, e como um protetor cardiovascular. Contudo, apesar da sua reputação de medicamento maravilha, os cientistas ainda não sabem exatamente como é que a aspirina funciona tão bem em tantos casos. Charles Serhan do Brigham and Women's Hospital, Boston é um bioquímico que está a tentar compreender a aspirina. A aspirina não é um mistério completo — os cientistas já sabem que o medicamento atua no alívio da dor através do bloqueio de circuitos bioquímicos que produzem dois compostos naturais no organismo, designados por prostaglandinas e tromboxanos. Baseando-se nisto, muitos investigadores assumiram que a capacidade da aspirina interromper a inflamação — a irritação dolorosa e o edema que resultam dos mecanismos de defesa químicos do nosso sistema imunitário — é uma consequência da sua atuação através dessa mesma via bioquímica. O trabalho de Serhan clarifica este assunto e pode até conduzir à produção de melhores medicamentos anti-inflamatórios. Após ter descoberto que a aspirina atua sobre a inflamação ao levar o organismo a sintetizar o seu próprio composto anti-inflamatório (uma molécula denominada 15-epi-lipoxina A4), Serhan decidiu produzir sósias químicos sintéticos desta molécula. Em estudos recentes em animais, pelo menos uma destas cópias sintéticas funcionou 100 vezes melhor do que a aspirina e do que outros potentes anti-inflamatórios disponíveis apenas com receita médica. A investigação de Serhan abre caminho na pesquisa de estratégias de tratamento mais seletivas com menos dos efeitos secundários indesejáveis associados à aspirina e a muitos outros medicamentos atualmente utilizados no tratamento das inflamações.
Medicamentos Personalizados
A tua dieta, o teu ambiente e o teu estilo de vida podem influenciar a tua resposta aos medicamentos. Mas os teus genes são outro fator chave. O estudo das diferentes formas de resposta das pessoas aos medicamentos em função do seu património genético designa-se por farmacogenética. A designação foi construída a partir das palavras farmacologia (o estudo do modo de atuação dos medicamentos no organismo) e genética (o estudo do modo como as características são herdadas). Um dos objetivos principais deste tipo de investigação médica consiste em compreender como é que as características genéticas únicas de uma pessoa determinam a eficácia da atuação de um medicamento no seu organismo, e quais os efeitos secundários que essa mesma pessoa pode estar propensa a desenvolver. No futuro, os avanços obtidos através de este tipo de investigação irão disponibilizar informação aos médicos no sentido de definir a quantidade certa do medicamento certo para uma pessoa — a prática da "medicina personalizada".
Caixa de Questões: Ferramentas para Novos Medicamentos
Inicialmente eu queria ser um químico agrícola, mas lidar com toda a matéria animal não era muito divertido. A química orgânica foi algo que descobri que gostava de fazer.

Robert Grubbs, um químico do California Institute of Technology, Pasadena, está a mudar o modo como as pessoas fazem as coisas. Todo o tipo de coisas — capacetes de bicicleta, canos resistentes à corrosão...e medicamentos! Grubbs introduziu uma reviravolta num tipo de reação química, denominado "metátese de olefinas" (transalquilidenação), que está na base da produção de uma grande variedade de materiais. Reações químicas deste tipo apoiam-se num elemento essencial para conseguir este feito: um catalisador extremamente versátil, que utiliza um metal, o ruténio. Os catalisadores, como moléculas que permitem que as reações ocorram, são essenciais para as transformações químicas que produzem os materiais que usamos e os medicamentos que tomamos. O catalisador de Grubbs é atualmente utilizado para produzir uma vasta diversidade de produtos biológicos e tem sido muito útil para os químicos da indústria farmacêutica, incumbidos da tarefa de sintetizar estruturas químicas complexas dia sim, dia não. A Química da Saúde pediu a Grubbs, que foi premiado com o Prémio Nobel da Química em 2005 pelo seu trabalho, para esclarecer alguns aspetos.
QS: Como pode o mesmo processo químico produzir coletes à prova de bala, repelentes de insetos e medicamentos?
Grubbs: O catalisador de ruténio que desenvolvemos desfaz ligações duplas carbono-carbono e depois liga novamente as peças — de maneiras previsíveis, ou mesmo novas. Essencialmente, o catalisador liga cadeias de moléculas entre si em anéis, que são um componente comum de todo o tipo de materiais. Mas também funciona desfazendo os anéis. É muito útil, porque há ligações duplas por todo o lado.
QS: Porque é que a comunidade química precisava de um novo catalisador?
Grubbs: Os catalisadores antigos não permitiam fazer as coisas muito eficientemente e os químicos tinham que utilizar grupos protetores. Metais como o ruténio dão aos químicos uma grande flexibilidade para fazer coisas utilizando uma grande variedade de matérias-primas, e em várias e diferentes condições. Simplesmente torna tudo mais fácil.
QS: Determinou-se a encontrar o catalisador?
Grubbs: Não, apesar de ter sido sempre um sonho meu. É engraçado — há 20 anos atrás, pediram-me para dar uma palestra prevendo o futuro na minha área de química. Defendi — fortemente, na altura — que recomendar apoio para esta investigação não deveria constar da declaração, dado que seria muito ambíguo para a comunidade. Fiquei surpreendido por ter corrido tão bem.
QS: O que é o fez interessar-se pela ciência?
Grubbs: Suponho que tenha sido um professor de ciências na escola. Mas as coisas mudaram um pouco. Inicialmente eu queria ser um químico agrícola, mas lidar com toda a matéria animal não era muito divertido. A química orgânica foi algo que descobri que gostava de fazer.
QS: O que é que o faz voltar ao laboratório todos os dias?
Grubbs: As surpresas que todos os dias surgem.
Compreendeste?
Qual é a função de um catalisador quiral?
Como podem os procedimentos de química sintética ajudar o ambiente?
Descreve a diferença entre péptidos e peptidomiméticos.
Refere uma razão pela qual os organismos filtradores marinhos libertam substâncias químicas para a água.
Comenta algumas das possíveis vantagens e desvantagens da medicina personalizada.


